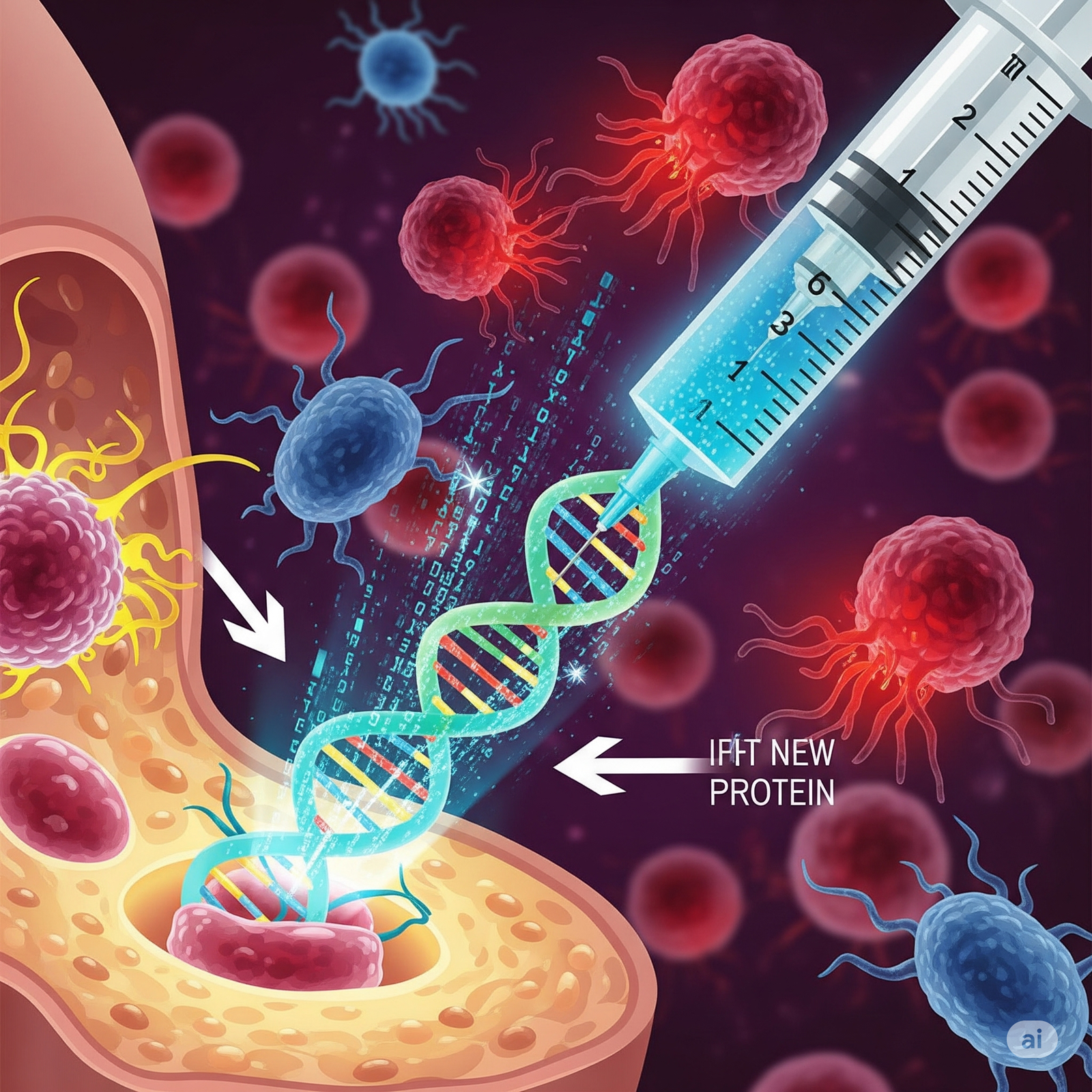
Vacinas contra câncer estão deixando de ser promessa distante para se tornarem uma realidade em construção. Vacinas terapêuticas personalizadas, plataformas de mRNA, vírus modificados e células treinadas estão mudando a forma como pensamos o tratamento oncológico. Mas como funcionam? Em que estágio estão? Elas vão substituir quimioterapia e radioterapia? Vamos decifrar — com clareza, leveza e foco em SEO — essa revolução silenciosa que pode transformar a luta contra o câncer.
🔬 O que é, afinal, uma vacina contra câncer?
Muito além de prevenir: tratar também é possível
Diferente das vacinas tradicionais (que previnem infecções virais ou bacterianas), muitas vacinas contra câncer são terapêuticas: elas ensinam o sistema imunológico a reconhecer e atacar células tumorais já existentes.
Existem duas grandes categorias:
- Profiláticas: evitam câncer relacionado a vírus (ex.: HPV e hepatite B).
- Terapêuticas: ativam o sistema imune contra tumores específicos já presentes no corpo.
🧠 Como as vacinas contra câncer funcionam?
Passo a passo simplificado
- Identificar um alvo: proteínas (antígenos) específicas do tumor.
- Apresentar o alvo ao sistema imune: via mRNA, peptídeos, células dendríticas ou vetores virais.
- Treinar as defesas: linfócitos T são estimulados a reconhecer e atacar as células cancerígenas.
- Memória imunológica: se tudo der certo, o organismo “lembra” do tumor e evita recidivas.
🧬 Tipos de vacinas contra câncer (e como cada uma age)
1. Vacinas de mRNA
- Como funcionam: entregam instruções genéticas para que o corpo produza fragmentos específicos do tumor.
- Vantagem: rápidas de desenvolver e personalizar.
- Desafio: estabilidade e logística de armazenamento.
2. Vacinas de neoantígenos personalizados
- Como funcionam: identificam mutações únicas de cada tumor (neoantígenos) por sequenciamento genético e constroem uma vacina sob medida.
- Vantagem: alta precisão, pois o alvo é exclusivo do paciente.
- Desafio: tempo e custo para produzir uma vacina por paciente.
3. Vacinas com células dendríticas
- Como funcionam: células do próprio paciente são “educadas” em laboratório com antígenos tumorais e depois reinfundidas.
- Vantagem: forte resposta imune adaptativa.
- Desafio: processo complexo e caro.
4. Vacinas com vetores virais (oncolíticos)
- Como funcionam: vírus modificados infectam tumor, explodem células cancerosas e soltam antígenos para ativar o sistema imune.
- Vantagem: dupla ação (destrói e sinaliza).
- Desafio: segurança e controle da resposta viral.
5. Peptídeos sintéticos e proteínas recombinantes
- Como funcionam: pequenos pedaços de proteínas tumorais são injetados com adjuvantes para despertar as defesas.
- Vantagem: simplicidade e custo menor.
- Desafio: resposta imune pode ser limitada sem bons adjuvantes.
🧭 Diferença entre vacinas profiláticas e terapêuticas
| Característica | Profiláticas | Terapêuticas |
| Objetivo | Prevenir câncer causado por vírus | Tratar um câncer já existente |
| Exemplos | HPV, Hepatite B | mRNA personalizada, células dendríticas |
| Público-alvo | População geral (antes da doença) | Pacientes diagnosticados |
| Tempo de ação | Longo prazo (antes da exposição) | Depende da resposta imune do paciente |
| Desafio principal | Cobertura vacinal | Personalização, custo e eficácia sustentada |
🧪 Onde estamos hoje? (sem jargão, sem hype vazio)
- Ensaios clínicos avançando: vários candidatos estão em fase II/III.
- Integração com imunoterapia: vacinas funcionam melhor combinadas com inibidores de checkpoint (como anti-PD-1/PD-L1).
- Cânceres-alvo mais estudados: melanoma, câncer de pulmão, mama, cabeça e pescoço, e tumores gastrointestinais.
- Personalização crescente: o sequenciamento rápido do tumor permite criar vacinas exclusivas em semanas.
🧱 Os grandes desafios das vacinas contra câncer
1. Heterogeneidade tumoral
Cada tumor é quase um “universo”: muta, evolui, cria “cópias” diferentes. Um alvo pode não valer para todas as células.
2. Velocidade x personalização
Vacinas personalizadas precisam ser produzidas rápido — o câncer não espera. Essa corrida logística custa caro.
3. Microambiente imunossupressor
Tumores criam um “escudo” químico que desliga o sistema imune. As vacinas precisam quebrar esse escudo.
4. Acesso e custo
Tecnologias de ponta podem demorar para chegar a sistemas públicos e populações de baixa renda.
🤖 IA e Big Data na criação de vacinas contra câncer
A inteligência artificial já analisa genomas, identifica neoantígenos e sugere combinações ideais para cada paciente.
- Predição de antígenos imunogênicos.
- Design de mRNA e peptídeos em minutos.
- Simulação de respostas imunes antes de ir para o laboratório.
🧍♀️🧍♂️ Experiência do paciente: como é receber uma vacina terapêutica?
- Biópsia ou cirurgia para coletar tecido tumoral.
- Sequenciamento genético para mapear mutações.
- Desenvolvimento da vacina personalizada (dias a semanas).
- Aplicações em múltiplas doses, muitas vezes combinadas com outras terapias.
- Monitoramento: exames de imagem, marcadores e resposta imune.
Efeitos colaterais? Geralmente mais leves que quimioterapia: febre, dor no local, fadiga. Mas cada plataforma tem seu perfil.
🧩 Vacinas contra câncer vão substituir a quimioterapia?
Provavelmente não “substituir”, mas complementar.
- Podem reduzir doses e efeitos colaterais.
- Podem evitar recidivas após cirurgia.
- Podem transformar câncer em doença controlável a longo prazo.
🌍 Impacto social e econômico
Acesso global
O desafio é garantir que vacinas contra câncer não fiquem restritas a países ricos. Produção local, patentes flexíveis e políticas públicas serão decisivas.
Sistemas de saúde
Terapias personalizadas exigem mudanças: logística de coleta de amostras, laboratórios de sequenciamento, biotecnologia de ponta.
⚖️ Questões éticas
- Privacidade genética: dados do tumor são únicos do paciente. Como armazenar e proteger?
- Prioridade no tratamento: quem recebe primeiro?
- Custo versus benefício: como equilibrar orçamento público e tratamentos caros?
📚 Curiosidades que valem o clique (e a reflexão)
- Já existem vacinas aprovadas para câncer de bexiga (BCG intravesical) e para alguns tipos de melanoma em contextos específicos.
- A plataforma de mRNA, popularizada em pandemias, acelerou também as pesquisas oncológicas.
- Tumores “friamente imunológicos” (com pouca infiltração de células imunes) são a pedra no sapato das vacinas — mas novas estratégias estão surgindo.
✅ Checklist: como saber se uma vacina oncológica é promissora?
- Alvo bem definido (antígeno exclusivo do tumor).
- Resposta imune mensurável (linfócitos T ativados).
- Resultados clínicos consistentes (redução de tumor, sobrevida maior).
- Perfil de segurança aceitável.
- Escalabilidade (capacidade de produzir para muita gente).
🔮 O que vem por aí?
- Vacinas combo: múltiplos antígenos + adjuvantes potentes + imunoterapia.
- Aplicações precoces: vacinas após cirurgia para evitar que o câncer volte.
- Uso preventivo: em pessoas com alto risco genético para certos tumores.
- “Atualizações” rápidas: como software, adaptar o alvo conforme o tumor muda.
🔗 Conclusão: revolução real, caminho ainda longo
A revolução das vacinas contra câncer está em curso — não é ficção. Mas também não é mágica instantânea. É uma combinação de ciência de ponta, bioinformática, imunologia, logística e políticas públicas.
Se tudo avançar como esperado, veremos menos sofrimento com efeitos colaterais brutais, mais tratamentos personalizados e, quem sabe, uma nova relação com o câncer: de sentença de medo para condição tratável e, em muitos casos, evitável.
📣 E você?
O que acha dessa revolução? Acredita que as vacinas contra câncer serão comuns nos hospitais nos próximos anos? Deixe seu comentário, compartilhe este artigo e ajude a espalhar informação de qualidade!